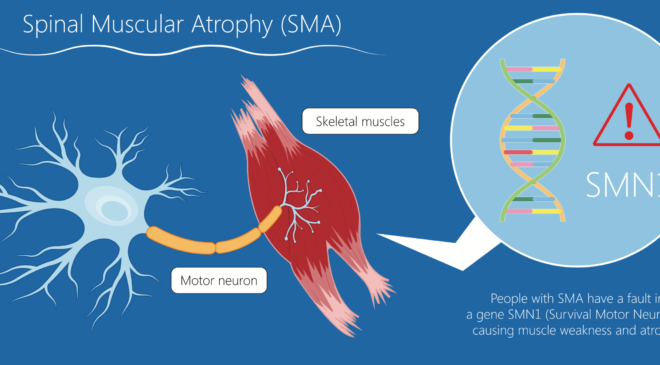
Sono stati presentati, mercoledì 4 ottobre, i risultati positivi dell’analisi primaria dello studio RAINBOWFISH attualmente in corso, volto a valutare l’efficacia e la sicurezza di risdiplam in bambini con atrofia muscolare spinale (SMA) pre-sintomatica (n = 26) tra zero e sei settimane di vita. I dati sono stati presentati al 28° congresso della World Muscle Society (WMS), in corso a Charleston, negli USA.
“Risdiplam è l’unico trattamento non invasivo per la SMA e può essere usato a poche ore di distanza dalla nascita, consentendo potenzialmente a questi bambini di stare seduti, stare in piedi e camminare in modo simile ai soggetti sani – osserva Levi Garraway, Chief Medical Officer e Head of Global Product Development di Roche – Risdiplam ha ormai dimostrato la sua sicurezza e la sua efficacia nei bambini e negli adulti, con dati importanti che continuano a rafforzare la nostra fiducia in questo trattamento”.
Gli studi clinici evidenziano che la perdita di motoneuroni può cominciare prima dell’esordio dei sintomi. Iniziare il trattamento precocemente è quindi essenziale per ottenere risultati migliori. Lo studio RAINBOWFISH ha incluso bambini con due o più copie del gene SMN2. In genere, minore è il numero di copie, maggiore è la gravità della malattia.
Lo studio ha soddisfatto l’endpoint primario, con l’80% della popolazione di efficacia primaria (n = 5) in grado di stare seduto senza supporto per almeno cinque secondi dopo 1 anno di trattamento con risdiplam, in base alla terza edizione delle Bayley Scales of Infant and Toddler Development (BSID-III). La popolazione di efficacia primaria includeva bambini con due copie di SMN2 e un’ampiezza del potenziale d’azione muscolare composto (CMAP) ≥ 1,5 mV al basale.
L’ampiezza del CMAP misura la risposta muscolare a uno stimolo. Un punteggio basso è correlato all’insorgenza dei sintomi nei pazienti con SMA e a esiti funzionali peggiori. Dei 26 bambini nello studio, l’81% era in grado di stare seduto autonomamente per 30 secondi, compresi tutti i pazienti con bassa ampiezza del CMAP al basale (< 1,5 mV), e la maggior parte stava in piedi e camminava. Senza trattamento, non ci si aspetterebbe mai che i bambini con SMA di tipo 1 stiano seduti.
Lo studio
Lo studio RAINBOWFISH è stata la prima sperimentazione a valutare la funzione cognitiva con una scala standardizzata (BSID) come endpoint esplorativo. I risultati hanno mostrato capacità cognitive tipiche del normale sviluppo infantile in base alla BSID-III dopo 1 anno di trattamento con risdiplam.
Gli eventi avversi registrati rispecchiavano più l’età dei bambini che la condizione di SMA sottostante. La maggior parte degli eventi avversi è stata considerata non correlata al trattamento e non si sono verificati decessi o eventi avversi che abbiano comportato il ritiro o l’interruzione del trattamento.
Gli eventi avversi più comuni sono stati dentizione, COVID-19, piressia, gastroenterite, eczema e stipsi; quelli osservati nell’analisi primaria dello studio RAINBOWFISH sono generalmente in linea con gli eventi avversi riscontrati in altre sperimentazioni su risdiplam nella SMA.
“Questi dati rafforzano l’importanza di iniziare il trattamento per la SMA prima della comparsa dei sintomi, con l’obiettivo di preservare i motoneuroni quando sono ancora numerosi” – osserva Richard Finkel, sperimentatore principale dello studio RAINBOWFISH e direttore del programma sperimentale di neuroscienze presso il St. Jude Children’s Research Hospital – Insieme ai diffusi programmi di screening dei neonati, il trattamento precoce potrebbe contrastare gli effetti della malattia e consentire ai bambini con SMA pre-sintomatica di iniziare la propria vita nel miglior modo possibile”.
Nella sperimentazione di fase II/III MANATEE Roche sta anche studiando risdiplam in associazione a una molecola anti-miostatina, concepita per promuovere la crescita muscolare, in pazienti con SMA di età compresa tra 2 e 10 anni